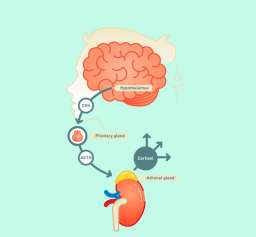
Влияние на здоровье и старение. Метилирование
Метилированием ДНК называют модификацию молекулы ДНК без изменения ее нуклеотидной последовательности. Метилирование ДНК вызывает модификацию генома, которая работает в клеточных процессах: структуре и стабильности хромосом, транскрипции ДНК и эмбриональном развитии. Метилирование ДНК влияет на старение и многие недуги.
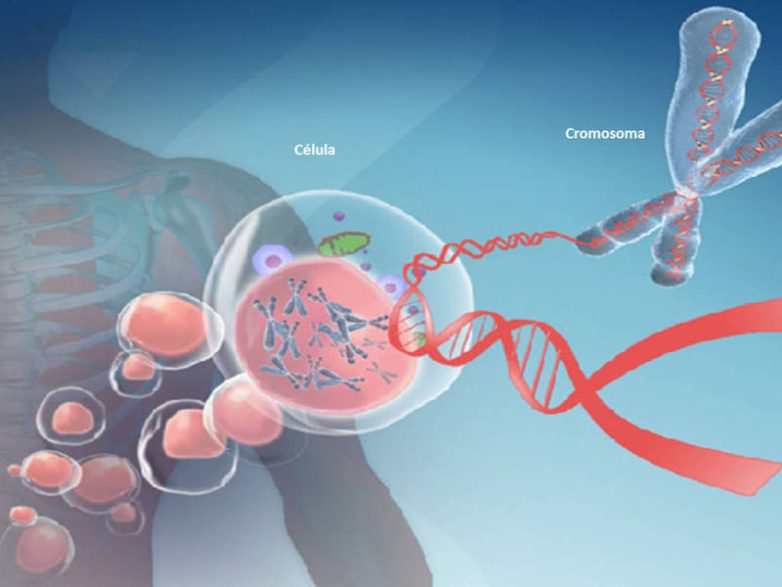
Метилирование ДНК изменяет геном человека и может влиять на старение и многие болезни. Одним из основных генов метилирования является ген MTHFR, самый изученный в нутригеномике. Этот ген участвует в превращении гомоцистеина в метионин с помощью фолиевой кислоты. Он также задействован в переработке серосодержащих аминокислот и производстве глутатиона, нашего главного антиоксиданта.
Метилирование – это процесс, при котором метильная группа (атом углерода с присоединенными к нему 3-мя атомами водорода) связывается с цитозиновыми нуклеотидами.
Ген MTHFR является ключевым игроком в этом процессе. Ген MTHFR кодирует белок МТНFR (метилентетрагидрофолатредуктазу) – фермент, участвующий в превращении гомоцистеина в метионин при наличии кофакторов – витамина В6, витамина В12 и фолиевой кислоты.
Ген МТНFR имеет несколько вариантов. Например, люди с двумя копиями варианта Rs1801133 или С677Т (всего 4% населения) продуцируют фермент МТНFR, активность которого снижена примерно на 70%.
Мы часто слышим о способах включения или выключения генов, но не часто звучит биохимическая основа метилирования: добавление метильной группы – это один из способов включения и выключения гена. В здоровых клетках метилирование обеспечивает правильную активацию или глушение генов.
Метилирование ДНК вызывает важнейшую модификацию генома, которая участвует в регуляции многих клеточных процессов. Эти процессы включают структуру и стабильность хромосом, транскрипцию ДНК и эмбриональное развитие.
Преобразование фолиевой кислоты в MTHF (или метилтетрагидрофолат) включают в себя множество ферментов, включая MTHFR:
Цикл метилирования начинается с гомоцистеина.
Одна из молекул, затронутых этим путем, участвует в создании ДНК.
Другая, MTR или метионинсинтаза, преобразует гомоцистеин в метионин. Он нуждается в витамине B12 и 5-MTHF, чтобы функционировать.
SAM-е (S-аденозилметионин) имеет присоединенную к нему метильную группу, которую он может “передать” нашей ДНК, вызывая метилирование ДНК.Конечным результатом цикла метилирования является метионин, но он также производит другие соединения, важные для антиоксидантной защиты, такие как глутатион и влияет на метаболизм фолиевой кислоты.
Но если цикл метилирования становится менее эффективным – например, если активность гена MTHFR снижена, а гомоцистеин недостаточно преобразуется в метионин, то происходит накопление гомоцистеина. Высокие показатели гомоцистеина являются большим фактором риска многих заболеваний – от воспаления и болезней сердца до диабета, аутоиммунных заболеваний (таких как псориаз), неврологических проблем, рака и других.

Что такое ген MTHFR?
Ген MTHFR кодирует фермент, известный как метилентетрагидрофолатредуктаза или MTHFR. Этот фермент отвечает за превращение 5, 10-метиленового ТHF в 5-метиловый ТHF, который необходим для превращения гомоцистеина в метионин.
Этот фермент очень важен для производства ДНК и путей метилирования, которые необходимы для всех функций организма.
MTHFR также играет центральную роль в трансформации фолиевой кислоты в SAM (аденозилметионин), универсальный метильный донор в клетках, и влияет на статус метилирования ДНК.
Типы метилирования ДНК
Метилирование – основа эпигенетики, науки о том, как окружающая среда влияет на наши гены. Окружающая среда обитания, образ жизни и диета – все это факторы, которые могут включать или выключать гены. Представленные здесь паттерны метилирования и деметилирования могут оказывать влияние на здоровье, старение и хронические заболевания, например, на риски развития рака.
Хотя избыточное и недостаточное метилирование может быть вредным, важно понимать, какие конкретные гены “включаются“ или “выключаются“. Активация или деактивация некоторых ключевых генов или областей может привести к наиболее серьезным осложнениям для здоровья (например, как гипометилирование так называемых повторяющихся последовательностей при раке).
Гиперметилирование ДНК
Здоровый организм имеет определенный уровень метилирования. Нерегулярная и чрезмерно метилированная ДНК может изменить активность гена, не позволяя ему делать то, на что он запрограммирован. Изменения в расположении метильных групп могут вызывать заболевания.
Некоторые ученые даже использовали количество метилирования в определенных генах в качестве биологических часов, так как метилирование в отдельных генах пропорционально возрасту. Такие последствия могут приводить к таким болезням, но не ограничиваются только ими:
Онкологические заболевания.
Снижение функции иммунной системы.
Ухудшение здоровья мозга.
Снижение энергии и возможностей физической активности.
Ускорение старения.
Слишком сильное метилирование ДНК может инактивировать и снижать экспрессию определенных генов-супрессоров опухоли, что способствует развитию рака.
Кроме того, внешние факторы окружающей среды могут изменять метилирование. Другими словами, в то время как аномальное метилирование в ДНК может быть передано по наследству, этот баланс также может быть изменен всем, что нас окружает.
Гипометилирование ДНК
Слишком мало метилирования также может быть вредным. При недостаточном метилировании ДНК в организме может возникнуть геномная нестабильность и клеточная трансформация.
И хотя считалось, что гиперметилирование чаще встречается при раке, более поздние исследования показали, что гипометилирование также играет определенную роль в онкологических заболеваниях. Гипометилирование может быть полезно при раке в краткосрочной перспективе, но оно также может ускорить рост опухоли.
Метилирование при раке было описано фразой – “слишком много, но также слишком мало”. При раке некоторые части ДНК пере-метилированы, а другие недо-метилированы, что приводит к полному дисбалансу нормального цикла метилирования ДНК.
Помимо рака, гипометилирование также может способствовать воспалению, приводя к атеросклерозу и аутоиммунным заболеваниям, таким как волчанка и рассеянный склероз.
Деметилирование ДНК
Деметилирование ДНК также может играть определенную роль в образовании злокачественных опухолей.
Во время развития эмбриона этот процесс имеет решающее значение. Ученые долго пытались понять, как сложные биохимические сигналы передаются в эмбрионе, чтобы идентичные стволовые клетки могли развиться в специализированные клетки, ткани и органы. Деметилирование происходит в ранних эмбрионах и имеет важное значение для дифференцировки стволовых клеток в определенные типы клеток. Оказалось, что участки ДНК включаются или выключаются, а затем модифицируются с помощью деметилирования для здорового развития организма.
Деметилирование устраняет модификацию нуклеотидов ДНК.
Метилирование и старение: эпигенетические часы
Метилирование – это не черно-белое явление. И дело не только в том, более или менее метилирована ваша ДНК, но и в том, как именно. Оказывается, метилирование усиливается в детском возрасте, когда происходит большая часть этого процесса. Но с возрастом только определенные участки ДНК, CpG-островки, становятся сверх-метилированными, в то время как остальные части ДНК – остаются недо-метилированными. Такое состояние считается признаком старения.
Основываясь на паттерне метилирования CpG, ученые теперь могут предсказать чей-то возраст. Это называется “эпигенетическими часами” – биомаркером старения, основанным на специфическом прогрессирующем паттерне метилирования, общем для большинства людей, который говорит нам о нашем “функциональном возрасте”. Но есть также “дрейф”, присущий каждому человеку, паттерн, немного отличающийся от общей популяции, который называется “эпигенетическим дрейфом”, что чаще всего исследуется учеными.
В принципе, основываясь на вашем паттерне метилирования ДНК, ученые могли бы определить ваш “эпигенетический возраст” и сравнить его с вашим фактическим возрастом. Исходя из этого, вы можете быть эпигенетически моложе или старше. И если вы эпигенетически старше, это может указывать на большую вероятность проблем со здоровьем в ближайшее время.
Варианты гена MTHFR
Генетические вариации в гене MTHFR приводят к снижению активности фермента MTHFR и связаны с рядом заболеваний и состояний организма, включая сердечно-сосудистые болезни, неврологические дефекты, некоторые формы рака, психические расстройства, диабет и осложнения беременности.
Две, наиболее распространенные мутации (полиморфизмы) гена MTHFR, обнаруженные у человека, являются: rs1801133 и rs1801131.
rs1801133 (MTHFR C677T)
Аллель А этого полиморфизма связан со снижением активности фермента MTHFR, повышением общего уровня гомоцистеина и изменением распределения фолиевой кислоты. (1) У людей с аллелем А наблюдается снижение нормальной активности MTHFR на 35%, а у людей с генотипом АА – на 70%. (5)
Особенности rs1801133:
Каждый аллель А был связан с более низкой активностью метилирования и более высоким уровнем гомоцистеина.
Генотип AA показывает снижение активности фермента MTHFR на 70%.
Генотип AG демонстрирует 30-40% сниженной активности фермента.
rs1801131 (MTHFR A1298C)
Эта мутация также влияет на активность фермента MTHFR и уровень гомоцистеина, но в меньшей степени, чем rs1801133. (1)
Ферментативная активность MTHFR у людей с одним минорным аллелем в мутации rs1801133 ниже, чем активность, присутствующая при одном минорном аллеле в мутации rs1801131.
Снижение активности фермента MTHFR приводит к снижению превращения аминокислоты гомоцистеина в метионин и накоплению гомоцистеина в крови. Аномально повышенные уровни гомоцистеина называют “гомоцистинурией” или “гипергомоцистеинемией”.
Повышение уровня гомоцистеина в крови может увеличить восприимчивость к ряду заболеваний.
Ряд исследований связал полиморфизмы MTHFR, особенно rs1801133, с различными заболеваниями, но результаты иногда были противоречивы. Это противоречие можно объяснить небольшими размерами выборки и этническими факторами, влияющими на презентацию заболеваний в различных популяциях по всему миру.
Заболевания, связанные с мутациями гена MTHFR
Ассоциация между данным генотипом и состоянием организма или болезнью не обязательно означает, что генотип вызывает эту болезнь. Тем не менее, аллель A в полиморфизме rs1801133 был связан со многими заболеваниями, включая:
Инсульты различного рода в различных популяциях людей и инсульты у детей.
Заболевания сердца при снижении уровня фолиевой кислоты. Высокое кровяное давление (также при генотипе GG MTHFR rs1801131). Мужское бесплодие, особенно в азиатских популяциях.
Депрессия (высокий уровень гомоцистеина и дисфункция метаболических путей метилирования имеют решающее значение для синтеза норадреналина и серотонина).
Расстройства аутистического спектра.
Болезнь Альцгеймера. Деменция. Болезнь Паркинсона. Рассеянный склероз (хотя доказательства противоречивы). Ревматоидный артрит.
Синдром дефицита внимания и гиперактивности (СДВГ) (при rs1801131). Мигрени с аурой или без нее. Другое исследование показало, что генотип АА был обратно связан с мигренями. Однако у людей с генотипом АА, у которых были мигрени, значительно чаще возникали проблемы с сердцем. Сахарный диабет и диабетические проблемы почек (нефропатия) у пациентов с сахарным диабетом 2-го типа. Риски варьируются между европейскими, азиатскими, арабскими и китайскими (ханьскими) популяциями.
Шизофрения.
Униполярное депрессивное расстройство и биполярное расстройство. Нарушение слуха.
Снижение плотности костной ткани в позвоночнике и его шейном отделе. Кластерная головная боль. Эпилепсия. Заболевания периферических артерий. Худшие исходы при терминальной стадии заболевания почек. Побочные эффекты приема метотрексата при ревматоидном артрите и повышенная токсичность для печени от метотрексата (блокатора фолатов).
Рецидивирующая потеря беременности (выкидыши).
Преэклампсия – серьезное осложнение беременности.
Синдром Дауна у ребенка (если у матери есть один или оба аллеля А).
Дефекты нейронной трубки, такие как анэнцефалия и расщепление позвоночника у новорожденных.
Расщелина губы и неба. Низкий уровень лютеинизирующего гормона. Катаракта. Очаговая алопеция. Более тяжелое течение колита.
Рак: ранее было доказано, что дефицит фолиевой кислоты может увеличить частоту различных форм рака. MTHFR непосредственно участвует в метаболизме фолатов, и поэтому мутации MTHFR могут оказывать влияние на развитие рака.
Повышенный риск развития – рак предстательной железы.
Рак яичников.
Рак пищевода.
Рак желудка: люди с аллелем А были более склонны к развитию рака желудка после инфекции H.Pylori.
Рак мочевого пузыря.
Рак головного мозга.
Рак легких.
Рак почки. Рак головы и шеи. Рак толстой кишки и другие побочные эффекты от лечения 5-фторурацилом.
Если у вас есть генотип, связанный с низкой активностью MTHFR, и вы обеспокоены каким-либо конкретным состоянием здоровья, то ваш врач может помочь разработать соответствующую стратегию профилактики.
Следует отметить, что большинство исследований, проведенных на генах MTHFR, показывают корреляции с заболеванием только тогда, когда уровень гомоцистеина высок или уровень фолатов низок. Поэтому вы можете спросить своего врача о необходимости сдачи анализов на уровень фолиевой кислоты или гомоцистеина. Высокие значения гомоцистеина показывают, что у вас может быть проблема метилирования или присутствует дефицит витаминов B12 / фолиевой кислоты, также вызванный возможной мутацией гена MTHFR.
Если ваши анализы показывают высокий уровень гомоцистеина, ваш врач, скорее всего, посоветует соответствующую диету и прием витаминов. Этот план, вероятно, будет включать повышенное потребление фолиевой кислоты, витамина В12 и витамина В6, которые влияют на уровень гомоцистеина в крови.
Богатая этими витаминами диета, включающая фрукты, овощи, темную листовую зелень (шпинат, капуста, бок-чой и швейцарский мангольд), яйца и красное мясо, обеспечивает нужное количество витаминов группы В, необходимые для поддержания низкого уровня гомоцистеина. Кроме того, добавление всех этих трех веществ может дополнительно улучшить уровень гомоцистеина.
У здоровой контрольной группы людей был выявлен уровень гомоцистеина менее 7 мкмоль/л, тогда как у больных шизофренией он составлял в среднем 12 мкмоль/л.
Биодоступность фолиевой кислоты
Недавно было обнаружено, что человеческий кишечник может очень эффективно преобразовывать фолаты из пищевых источников в 5-MTHF (тип фолата, который может использовать наш организм). Однако его способность превращать дополнительный искусственный фолат – ограничена.
Восстановленный фолат ((6S) 5-MTHF) – это биодоступная форма фолиевой кислоты, которая легко усваивается и метаболизируется в организме человека. Он доступен в виде добавок, обычно маркированных как L-метилтетрагидрофолат или метилфолат.
Кроме того, вы можете добавить метил-витамин В12 (метилкобаламин), более биодоступную форму витамина В12, вместо обычного витамина В12. Это облегчит доступ к витамину В12 для вашего организма.
Если у вас обнаружены генотипы АА rs1801133 и GG rs1801131 в гене MTHFR, то лучше всего для вашего здоровья, если вы поговорите с врачом о добавках и других вариантах улучшения состояния.
Потребность в фолиевой кислоте
В настоящее время рекомендуемый уровень получения фолиевой кислоты составляет 400 мкг/сут для среднего взрослого человека с увеличением до 600 мкг/сут для беременных и кормящих женщин.
Имейте в виду, что добавление фолатов, как известно, маскирует существующую анемию, вызванную недостаточным уровнем витамина В12. Чтобы избежать дефицита B12, держите своего врача в курсе любых добавок или лекарств, которые вы решите принимать.
Увеличение потребления холина
Холин может помочь вашему организму обойти недостаток фолиевой кислоты в цикле метилирования. Хорошие источники холина включают яичные желтки, говяжью печень и зародыши пшеницы. Метаболит холина, бетаин, на самом деле является тем, что работает через цикл метилирования, поэтому пищевые источники бетаина (свекла, киноа и шпинат) также будут полезны. Существуют добавки с бетаином (называются TMG).
Исследования с участием человека
Симвастатин ®
Сульфасалазин ®
Тестостерон ®
Витамин D ®
Вальпроевая кислота ®
Никель (Р Р)
Табачный дым ®
Исследование на грызунах
Индол-3-карбинол ®
Снижение активности
Исследования с участием человека
Метотрексат ®
Гомоцистеин ®
Тамоксифен ®
Третиноин ®
Ралоксифен гидрохлорид ®
Парацетамол ®
Тоцилизумаб ®
Пентанал ® (содержится в оливковом масле и нескольких эфирных маслах. Также присутствует в пиве Банту, сливовом бренди, кардамоне, листьях кориандра, рисе, бурбонской ванили, мускатном шалфее, вареных креветках, морских гребешках, яблоках, бананах, черешне, черной смородине и других продуктах).
Исследования на грызунах
Диета с высоким содержанием жиров (особенно при ожирении) ®.
Бисфенол А.

Метилирование ДНК изменяет геном человека и может влиять на старение и многие болезни. Одним из основных генов метилирования является ген MTHFR, самый изученный в нутригеномике. Этот ген участвует в превращении гомоцистеина в метионин с помощью фолиевой кислоты. Он также задействован в переработке серосодержащих аминокислот и производстве глутатиона, нашего главного антиоксиданта.
Метилирование ДНК изменяет геном человека
Что такое метилирование?Метилирование – это процесс, при котором метильная группа (атом углерода с присоединенными к нему 3-мя атомами водорода) связывается с цитозиновыми нуклеотидами.
Ген MTHFR является ключевым игроком в этом процессе. Ген MTHFR кодирует белок МТНFR (метилентетрагидрофолатредуктазу) – фермент, участвующий в превращении гомоцистеина в метионин при наличии кофакторов – витамина В6, витамина В12 и фолиевой кислоты.
Ген МТНFR имеет несколько вариантов. Например, люди с двумя копиями варианта Rs1801133 или С677Т (всего 4% населения) продуцируют фермент МТНFR, активность которого снижена примерно на 70%.
Мы часто слышим о способах включения или выключения генов, но не часто звучит биохимическая основа метилирования: добавление метильной группы – это один из способов включения и выключения гена. В здоровых клетках метилирование обеспечивает правильную активацию или глушение генов.
Метилирование ДНК вызывает важнейшую модификацию генома, которая участвует в регуляции многих клеточных процессов. Эти процессы включают структуру и стабильность хромосом, транскрипцию ДНК и эмбриональное развитие.
Преобразование фолиевой кислоты в MTHF (или метилтетрагидрофолат) включают в себя множество ферментов, включая MTHFR:
Цикл метилирования начинается с гомоцистеина.
Одна из молекул, затронутых этим путем, участвует в создании ДНК.
Другая, MTR или метионинсинтаза, преобразует гомоцистеин в метионин. Он нуждается в витамине B12 и 5-MTHF, чтобы функционировать.
SAM-е (S-аденозилметионин) имеет присоединенную к нему метильную группу, которую он может “передать” нашей ДНК, вызывая метилирование ДНК.Конечным результатом цикла метилирования является метионин, но он также производит другие соединения, важные для антиоксидантной защиты, такие как глутатион и влияет на метаболизм фолиевой кислоты.
Но если цикл метилирования становится менее эффективным – например, если активность гена MTHFR снижена, а гомоцистеин недостаточно преобразуется в метионин, то происходит накопление гомоцистеина. Высокие показатели гомоцистеина являются большим фактором риска многих заболеваний – от воспаления и болезней сердца до диабета, аутоиммунных заболеваний (таких как псориаз), неврологических проблем, рака и других.

Что такое ген MTHFR?
Ген MTHFR кодирует фермент, известный как метилентетрагидрофолатредуктаза или MTHFR. Этот фермент отвечает за превращение 5, 10-метиленового ТHF в 5-метиловый ТHF, который необходим для превращения гомоцистеина в метионин.
Этот фермент очень важен для производства ДНК и путей метилирования, которые необходимы для всех функций организма.
MTHFR также играет центральную роль в трансформации фолиевой кислоты в SAM (аденозилметионин), универсальный метильный донор в клетках, и влияет на статус метилирования ДНК.
Типы метилирования ДНК
Метилирование – основа эпигенетики, науки о том, как окружающая среда влияет на наши гены. Окружающая среда обитания, образ жизни и диета – все это факторы, которые могут включать или выключать гены. Представленные здесь паттерны метилирования и деметилирования могут оказывать влияние на здоровье, старение и хронические заболевания, например, на риски развития рака.
Хотя избыточное и недостаточное метилирование может быть вредным, важно понимать, какие конкретные гены “включаются“ или “выключаются“. Активация или деактивация некоторых ключевых генов или областей может привести к наиболее серьезным осложнениям для здоровья (например, как гипометилирование так называемых повторяющихся последовательностей при раке).
Гиперметилирование ДНК
Здоровый организм имеет определенный уровень метилирования. Нерегулярная и чрезмерно метилированная ДНК может изменить активность гена, не позволяя ему делать то, на что он запрограммирован. Изменения в расположении метильных групп могут вызывать заболевания.
Некоторые ученые даже использовали количество метилирования в определенных генах в качестве биологических часов, так как метилирование в отдельных генах пропорционально возрасту. Такие последствия могут приводить к таким болезням, но не ограничиваются только ими:
Онкологические заболевания.
Снижение функции иммунной системы.
Ухудшение здоровья мозга.
Снижение энергии и возможностей физической активности.
Ускорение старения.
Слишком сильное метилирование ДНК может инактивировать и снижать экспрессию определенных генов-супрессоров опухоли, что способствует развитию рака.
Кроме того, внешние факторы окружающей среды могут изменять метилирование. Другими словами, в то время как аномальное метилирование в ДНК может быть передано по наследству, этот баланс также может быть изменен всем, что нас окружает.
Гипометилирование ДНК
Слишком мало метилирования также может быть вредным. При недостаточном метилировании ДНК в организме может возникнуть геномная нестабильность и клеточная трансформация.
И хотя считалось, что гиперметилирование чаще встречается при раке, более поздние исследования показали, что гипометилирование также играет определенную роль в онкологических заболеваниях. Гипометилирование может быть полезно при раке в краткосрочной перспективе, но оно также может ускорить рост опухоли.
Метилирование при раке было описано фразой – “слишком много, но также слишком мало”. При раке некоторые части ДНК пере-метилированы, а другие недо-метилированы, что приводит к полному дисбалансу нормального цикла метилирования ДНК.
Помимо рака, гипометилирование также может способствовать воспалению, приводя к атеросклерозу и аутоиммунным заболеваниям, таким как волчанка и рассеянный склероз.
Деметилирование ДНК
Деметилирование ДНК также может играть определенную роль в образовании злокачественных опухолей.
Во время развития эмбриона этот процесс имеет решающее значение. Ученые долго пытались понять, как сложные биохимические сигналы передаются в эмбрионе, чтобы идентичные стволовые клетки могли развиться в специализированные клетки, ткани и органы. Деметилирование происходит в ранних эмбрионах и имеет важное значение для дифференцировки стволовых клеток в определенные типы клеток. Оказалось, что участки ДНК включаются или выключаются, а затем модифицируются с помощью деметилирования для здорового развития организма.
Деметилирование устраняет модификацию нуклеотидов ДНК.
Метилирование и старение: эпигенетические часы
Метилирование – это не черно-белое явление. И дело не только в том, более или менее метилирована ваша ДНК, но и в том, как именно. Оказывается, метилирование усиливается в детском возрасте, когда происходит большая часть этого процесса. Но с возрастом только определенные участки ДНК, CpG-островки, становятся сверх-метилированными, в то время как остальные части ДНК – остаются недо-метилированными. Такое состояние считается признаком старения.
Основываясь на паттерне метилирования CpG, ученые теперь могут предсказать чей-то возраст. Это называется “эпигенетическими часами” – биомаркером старения, основанным на специфическом прогрессирующем паттерне метилирования, общем для большинства людей, который говорит нам о нашем “функциональном возрасте”. Но есть также “дрейф”, присущий каждому человеку, паттерн, немного отличающийся от общей популяции, который называется “эпигенетическим дрейфом”, что чаще всего исследуется учеными.
В принципе, основываясь на вашем паттерне метилирования ДНК, ученые могли бы определить ваш “эпигенетический возраст” и сравнить его с вашим фактическим возрастом. Исходя из этого, вы можете быть эпигенетически моложе или старше. И если вы эпигенетически старше, это может указывать на большую вероятность проблем со здоровьем в ближайшее время.
Варианты гена MTHFR
Генетические вариации в гене MTHFR приводят к снижению активности фермента MTHFR и связаны с рядом заболеваний и состояний организма, включая сердечно-сосудистые болезни, неврологические дефекты, некоторые формы рака, психические расстройства, диабет и осложнения беременности.
Две, наиболее распространенные мутации (полиморфизмы) гена MTHFR, обнаруженные у человека, являются: rs1801133 и rs1801131.
rs1801133 (MTHFR C677T)
Аллель А этого полиморфизма связан со снижением активности фермента MTHFR, повышением общего уровня гомоцистеина и изменением распределения фолиевой кислоты. (1) У людей с аллелем А наблюдается снижение нормальной активности MTHFR на 35%, а у людей с генотипом АА – на 70%. (5)
Особенности rs1801133:
Каждый аллель А был связан с более низкой активностью метилирования и более высоким уровнем гомоцистеина.
Генотип AA показывает снижение активности фермента MTHFR на 70%.
Генотип AG демонстрирует 30-40% сниженной активности фермента.
rs1801131 (MTHFR A1298C)
Эта мутация также влияет на активность фермента MTHFR и уровень гомоцистеина, но в меньшей степени, чем rs1801133. (1)
Ферментативная активность MTHFR у людей с одним минорным аллелем в мутации rs1801133 ниже, чем активность, присутствующая при одном минорном аллеле в мутации rs1801131.
Снижение активности фермента MTHFR приводит к снижению превращения аминокислоты гомоцистеина в метионин и накоплению гомоцистеина в крови. Аномально повышенные уровни гомоцистеина называют “гомоцистинурией” или “гипергомоцистеинемией”.
Повышение уровня гомоцистеина в крови может увеличить восприимчивость к ряду заболеваний.
Ряд исследований связал полиморфизмы MTHFR, особенно rs1801133, с различными заболеваниями, но результаты иногда были противоречивы. Это противоречие можно объяснить небольшими размерами выборки и этническими факторами, влияющими на презентацию заболеваний в различных популяциях по всему миру.
Заболевания, связанные с мутациями гена MTHFR
Ассоциация между данным генотипом и состоянием организма или болезнью не обязательно означает, что генотип вызывает эту болезнь. Тем не менее, аллель A в полиморфизме rs1801133 был связан со многими заболеваниями, включая:
Инсульты различного рода в различных популяциях людей и инсульты у детей.
Заболевания сердца при снижении уровня фолиевой кислоты. Высокое кровяное давление (также при генотипе GG MTHFR rs1801131). Мужское бесплодие, особенно в азиатских популяциях.
Депрессия (высокий уровень гомоцистеина и дисфункция метаболических путей метилирования имеют решающее значение для синтеза норадреналина и серотонина).
Расстройства аутистического спектра.
Болезнь Альцгеймера. Деменция. Болезнь Паркинсона. Рассеянный склероз (хотя доказательства противоречивы). Ревматоидный артрит.
Синдром дефицита внимания и гиперактивности (СДВГ) (при rs1801131). Мигрени с аурой или без нее. Другое исследование показало, что генотип АА был обратно связан с мигренями. Однако у людей с генотипом АА, у которых были мигрени, значительно чаще возникали проблемы с сердцем. Сахарный диабет и диабетические проблемы почек (нефропатия) у пациентов с сахарным диабетом 2-го типа. Риски варьируются между европейскими, азиатскими, арабскими и китайскими (ханьскими) популяциями.
Шизофрения.
Униполярное депрессивное расстройство и биполярное расстройство. Нарушение слуха.
Снижение плотности костной ткани в позвоночнике и его шейном отделе. Кластерная головная боль. Эпилепсия. Заболевания периферических артерий. Худшие исходы при терминальной стадии заболевания почек. Побочные эффекты приема метотрексата при ревматоидном артрите и повышенная токсичность для печени от метотрексата (блокатора фолатов).
Рецидивирующая потеря беременности (выкидыши).
Преэклампсия – серьезное осложнение беременности.
Синдром Дауна у ребенка (если у матери есть один или оба аллеля А).
Дефекты нейронной трубки, такие как анэнцефалия и расщепление позвоночника у новорожденных.
Расщелина губы и неба. Низкий уровень лютеинизирующего гормона. Катаракта. Очаговая алопеция. Более тяжелое течение колита.
Рак: ранее было доказано, что дефицит фолиевой кислоты может увеличить частоту различных форм рака. MTHFR непосредственно участвует в метаболизме фолатов, и поэтому мутации MTHFR могут оказывать влияние на развитие рака.
Повышенный риск развития – рак предстательной железы.
Рак яичников.
Рак пищевода.
Рак желудка: люди с аллелем А были более склонны к развитию рака желудка после инфекции H.Pylori.
Рак мочевого пузыря.
Рак головного мозга.
Рак легких.
Рак почки. Рак головы и шеи. Рак толстой кишки и другие побочные эффекты от лечения 5-фторурацилом.
Если у вас есть генотип, связанный с низкой активностью MTHFR, и вы обеспокоены каким-либо конкретным состоянием здоровья, то ваш врач может помочь разработать соответствующую стратегию профилактики.
Дополнительные возможности по влиянию на метилирование ДНК
Анализы на уровень гомоцистеина и фолиевой кислотыСледует отметить, что большинство исследований, проведенных на генах MTHFR, показывают корреляции с заболеванием только тогда, когда уровень гомоцистеина высок или уровень фолатов низок. Поэтому вы можете спросить своего врача о необходимости сдачи анализов на уровень фолиевой кислоты или гомоцистеина. Высокие значения гомоцистеина показывают, что у вас может быть проблема метилирования или присутствует дефицит витаминов B12 / фолиевой кислоты, также вызванный возможной мутацией гена MTHFR.
Если ваши анализы показывают высокий уровень гомоцистеина, ваш врач, скорее всего, посоветует соответствующую диету и прием витаминов. Этот план, вероятно, будет включать повышенное потребление фолиевой кислоты, витамина В12 и витамина В6, которые влияют на уровень гомоцистеина в крови.
Богатая этими витаминами диета, включающая фрукты, овощи, темную листовую зелень (шпинат, капуста, бок-чой и швейцарский мангольд), яйца и красное мясо, обеспечивает нужное количество витаминов группы В, необходимые для поддержания низкого уровня гомоцистеина. Кроме того, добавление всех этих трех веществ может дополнительно улучшить уровень гомоцистеина.
У здоровой контрольной группы людей был выявлен уровень гомоцистеина менее 7 мкмоль/л, тогда как у больных шизофренией он составлял в среднем 12 мкмоль/л.
Биодоступность фолиевой кислоты
Недавно было обнаружено, что человеческий кишечник может очень эффективно преобразовывать фолаты из пищевых источников в 5-MTHF (тип фолата, который может использовать наш организм). Однако его способность превращать дополнительный искусственный фолат – ограничена.
Восстановленный фолат ((6S) 5-MTHF) – это биодоступная форма фолиевой кислоты, которая легко усваивается и метаболизируется в организме человека. Он доступен в виде добавок, обычно маркированных как L-метилтетрагидрофолат или метилфолат.
Кроме того, вы можете добавить метил-витамин В12 (метилкобаламин), более биодоступную форму витамина В12, вместо обычного витамина В12. Это облегчит доступ к витамину В12 для вашего организма.
Если у вас обнаружены генотипы АА rs1801133 и GG rs1801131 в гене MTHFR, то лучше всего для вашего здоровья, если вы поговорите с врачом о добавках и других вариантах улучшения состояния.
Потребность в фолиевой кислоте
В настоящее время рекомендуемый уровень получения фолиевой кислоты составляет 400 мкг/сут для среднего взрослого человека с увеличением до 600 мкг/сут для беременных и кормящих женщин.
Имейте в виду, что добавление фолатов, как известно, маскирует существующую анемию, вызванную недостаточным уровнем витамина В12. Чтобы избежать дефицита B12, держите своего врача в курсе любых добавок или лекарств, которые вы решите принимать.
Увеличение потребления холина
Холин может помочь вашему организму обойти недостаток фолиевой кислоты в цикле метилирования. Хорошие источники холина включают яичные желтки, говяжью печень и зародыши пшеницы. Метаболит холина, бетаин, на самом деле является тем, что работает через цикл метилирования, поэтому пищевые источники бетаина (свекла, киноа и шпинат) также будут полезны. Существуют добавки с бетаином (называются TMG).
Способы влияния на ген MTHFR
Увеличение активности MTHFRИсследования с участием человека
Симвастатин ®
Сульфасалазин ®
Тестостерон ®
Витамин D ®
Вальпроевая кислота ®
Никель (Р Р)
Табачный дым ®
Исследование на грызунах
Индол-3-карбинол ®
Снижение активности
Исследования с участием человека
Метотрексат ®
Гомоцистеин ®
Тамоксифен ®
Третиноин ®
Ралоксифен гидрохлорид ®
Парацетамол ®
Тоцилизумаб ®
Пентанал ® (содержится в оливковом масле и нескольких эфирных маслах. Также присутствует в пиве Банту, сливовом бренди, кардамоне, листьях кориандра, рисе, бурбонской ванили, мускатном шалфее, вареных креветках, морских гребешках, яблоках, бананах, черешне, черной смородине и других продуктах).
Исследования на грызунах
Диета с высоким содержанием жиров (особенно при ожирении) ®.
Бисфенол А.
+2
22
- Комментарии
Нет комментариев. Ваш будет первым!
Войдите или зарегистрируйтесь чтобы добавлять комментарии