Как энтропия движет Вселенной

Слово «энтропия» и словосочетание «закон термодинамики» сегодня встречаются все чаще — в книгах, кино, интернете. Но мало кто знает, что означают эти понятия и какие процессы они описывают.
Может ли двигатель работать со 100%-ной эффективностью? В 1824 году на этот вопрос попытался ответить ученый по имени Николя Леонар Сади Карно, также известный как «отец термодинамики». В одной из своих теоретических моделей он поместил цилиндр с поршнем между двумя тепловыми резервуарами. Оба резервуара сохраняли постоянную температуру, но температура одного из них была выше, чем у другого.
Идея была в том, чтобы преобразить поток тепла между двумя резервуарами в работу. Именно для этого Карно и поместил цилиндр с поршнем между резервуарами. Однако он понял, что 100%-ной производительности добиться не удастся: часть тепла всегда уходила через цилиндр в холодный резервуар.
Первое начало термодинамики утверждает, что энергия не может быть создана или уничтожена — она может только менять свою форму. Но тут есть некоторые ограничения. Закон не определяет направление, в котором может произойти изменение, и не сообщает об обратимости этого изменения. Если мы сбросим с возвышения объект, потенциальная энергия преображается в кинетическую, и он падает. Однако после столкновения с землей он не отскочит обратно на ту же высоту, с которой упал. Почему так происходит? Чтобы понять это, необходимо рассмотреть важный термин — спонтанный процесс.
Может ли двигатель работать со 100%-ной эффективностью? В 1824 году на этот вопрос попытался ответить ученый по имени Николя Леонар Сади Карно, также известный как «отец термодинамики». В одной из своих теоретических моделей он поместил цилиндр с поршнем между двумя тепловыми резервуарами. Оба резервуара сохраняли постоянную температуру, но температура одного из них была выше, чем у другого.
Идея была в том, чтобы преобразить поток тепла между двумя резервуарами в работу. Именно для этого Карно и поместил цилиндр с поршнем между резервуарами. Однако он понял, что 100%-ной производительности добиться не удастся: часть тепла всегда уходила через цилиндр в холодный резервуар.
Первое начало термодинамики утверждает, что энергия не может быть создана или уничтожена — она может только менять свою форму. Но тут есть некоторые ограничения. Закон не определяет направление, в котором может произойти изменение, и не сообщает об обратимости этого изменения. Если мы сбросим с возвышения объект, потенциальная энергия преображается в кинетическую, и он падает. Однако после столкновения с землей он не отскочит обратно на ту же высоту, с которой упал. Почему так происходит? Чтобы понять это, необходимо рассмотреть важный термин — спонтанный процесс.
Спонтанный процесс
Спонтанным процессом в термодинамике называется процесс, способный произойти без какого-либо вмешательства извне: у него должно быть достаточно времени на это. Капните в стакан с водой чернила — они «спонтанно» распространятся по всему стакану, тогда как сахар необходимо размешать, чтобы он растворился. Когда на улице жарко, комната нагревается «спонтанно», но, чтобы охладить ее, вам потребуется кондиционер.

Спонтанное распространение чернил в воде / Reddit/BigMurph
Исходя из собственного опыта мы знаем, что некоторые происходящие в наших жизнях события спонтанны. Однако ученым надо было найти способ определения спонтанности любого события. Им был необходим способ определения направления, в котором происходит изменение. Эта самая нужда породила то, что сегодня мы называем вторым началом термодинамики.
Второе начало термодинамики
Законы термодинамики определяют, как работа, тепло и энергия влияют на какую-либо систему. Система — это любая ограниченная область во Вселенной, по которой может передаваться энергия. Все, что находится за пределами этой системы, считается ее окружением.
Второе начало термодинамики утверждает, что в спонтанном процессе общая энтропия Вселенной всегда возрастает. Что же такое энтропия?
Энтропия
Если вы вдруг никогда прежде не сталкивались с этим термином, можете ассоциировать его с «беспорядком». Однако в термодинамике определение энтропии чуть более развернуто.
Прежде всего, чтобы понять, что такое энтропия, надо уяснить, что все энергии квантованы. Когда электроны в атоме получают энергию, они впитывают ее только в целых кратных небольшого количества энергии, называемого «квантом».
Когда капля чернил падает в стакан воды, она распространяется по жидкости. Так же, если у вас на столе лежит кусок горячего металла, его тепло распространяется по всей окружающей его среде. Представьте себе, что у вас есть коробка с пятью молекулами газа, которая стоит рядом с этим куском металла. Металл передаст пять квантов тепла газу. Получит ли каждая молекула газа по одному кванту энергии? Не обязательно.
Вполне возможно, что две молекулы получат по два кванта, а одна — только один, тогда как две другие единицы не получат вообще ничего. Возможно, что одна молекула получит три кванта, другая — два, остальные — ничего. В этом случае есть целых 126 возможных комбинаций процесса передачи квантов тепла
Эти молекулы газа также могут сталкиваться друг с другом и обмениваться кинетической энергией. Однако общая энергия не может превзойти количество предоставленной системе энергии.
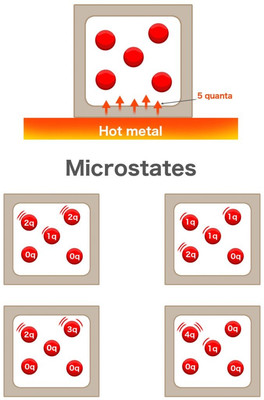
Эксперимент с горячим металлом и коробкой с пятью молекулами газа / Science ABC
Каждая из этих комбинаций называется микросостоянием. Общий уровень энергии называется макросостоянием. Энтропия — это мера вероятностей распределения энергии между молекулами.
Энтропия — переменная состояния, которая описывает физическое состояние системы — вроде давления, температуры и объема. Энтропию можно объяснить следующей математической формулой:
S=kBlnΩ,
где S — энтропия, kB — постоянная Больцмана, Ω — мера вероятности. Постоянная Больцмана — это физическая константа, определяющая среднюю кинетическую энергию частиц газа в соотношении с температурой. Для вычисления энтропии эта константа умножается на натуральный логарифм числа микросостояний (мера вероятности).
Изменение в энтропии также можно вычислить делением полученного тепла на температуру. Полученное тепло повышает кинетическую энергию частиц.
По сути, энтропия — это значение числа способов распределения энергии между молекулами, находящимися в системе.
Энтропия теплового двигателя
Вернемся к двигателю Карно и попробуем выяснить, при каких условиях возможен тепловой двигатель. Предположим, что температура горячего резервуара имеет значение TH, а температура холодного резервуара — TC. Количество тепла QH извлекается из резервуара для выполнения работы.
Таким образом, изменение энтропии в горячем резервуаре можно вычислить по следующей формуле:
ΔSH = -QH / TH
Q — отрицательна, так как тепло извлекается из резервуара.
После выполнения работы поршнем в двигателе и его возвращения в изначальное состояние изменение энтропии двигателя (ΔSE) будет иметь значение 0.
Если мы предположим, что для выполнения работы используется вся энергия, а холодный резервуар совсем не получает тепла, то энтропия холодного резервуара (ΔSС) тоже будет иметь значение 0.
Следовательно:
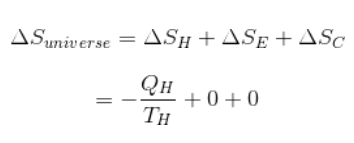
Общая энтропия Вселенной становится отрицательной, а значит, не может быть спонтанной.
Теперь предположим, что холодный резервуар получает количество тепла QC и не используется для выполнения работы. В таком случае энтропия холодного резервуара: (ΔSC) — QC / TC.
Так мы получаем следующее:
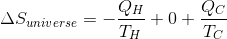
Единственный случай, при котором двигатель может работать, — когда энтропия Вселенной (ΔSuniverse) положительна или если положительно значение QC / TC — QH / TH, как и гласит второе начало термодинамики.
Универсальный закон
Второе начало термодинамики движет Вселенной. Нам известно, что Вселенная расширяется. Согласно второму началу термодинамики, энтропия Вселенной также должна возрастать. Звезды — источник энергии Вселенной. К тому моменту, когда последняя звезда испустит свой последний фотон, уровень энтропии будет невероятно высок. Переживать по этому поводу не стоит: все мы уйдем в небытие задолго до этого. Тогда-то и погибнет Вселенная, так как больше не останется энергии для увеличения ее энтропии.
+1
298
- Комментарии
Нет комментариев. Ваш будет первым!
Войдите или зарегистрируйтесь чтобы добавлять комментарии














